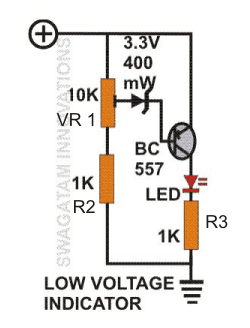
เซลล์แห้งเป็นแหล่งผลิตไฟฟ้าที่ง่ายที่สุด เซลล์จำนวนหนึ่งรวมกันเป็นแบตเตอรี่ กรดตะกั่ว หรือนิกเกิลแคดเมียม แบตเตอรี่ เป็นเซลล์แห้งรุ่นขั้นสูง เซลล์นี้ถูกประดิษฐ์ขึ้นครั้งแรกโดยวิศวกรชาวฝรั่งเศส Georges Leclanche ในปี พ.ศ. 2409 สิ่งประดิษฐ์ของเขาได้รับการตั้งชื่อตามชื่อของเขาว่าแบตเตอรี่ Leclanche แต่ตอนนั้นมันหนักมากและอาจหักได้ง่าย เซลล์แห้งมีหลักการเดียวกันและเป็นแบตเตอรี่ Leclanche รุ่นขั้นสูงและมีแรงดันไฟฟ้าและขนาดต่างกัน รูปแบบทางการค้าของเซลล์สังกะสี - คาร์บอนซึ่งเป็นรูปแบบที่ดัดแปลงของแบตเตอรี่ Leclanche ถูกคิดค้นขึ้นในปีพ. ศ. 2424 โดย Carl Gassner จากไมนซ์ ผลิตในปริมาณมากและใช้ในงานต่างๆเช่นของเล่นวิทยุเครื่องคิดเลข ฯลฯ
Dry Cell คืออะไร?
เซลล์แห้งเป็นอุปกรณ์ที่สร้างกระแสไฟฟ้าโดยอาศัยปฏิกิริยาทางเคมี เมื่ออิเล็กโทรดทั้งสองของเซลล์เชื่อมต่อกันผ่านทางปิดเซลล์จะบังคับให้อิเล็กตรอนไหลจากปลายด้านหนึ่งไปยังอีกด้านหนึ่ง การไหลของอิเล็กตรอนทำให้กระแสไฟฟ้าไหลในวงจรปิด

ชั้นเซลล์แห้ง
ด้วยความช่วยเหลือของปฏิกิริยาทางเคมีอิเล็กตรอนจะไหลจากปลายด้านหนึ่งไปอีกด้านหนึ่ง เมื่อเซลล์สองเซลล์ขึ้นไปเชื่อมต่อด้วยขั้วที่ถูกต้องจะมีการไหลของอิเล็กตรอนมากขึ้นเนื่องจากมีศักยภาพสูง การรวมกันนี้เรียกว่าแบตเตอรี่ จากแรงดันไฟฟ้าขั้นต่ำ 1.5 V ถึง 100 V สามารถใช้แบตเตอรี่เพื่อให้ได้ช่วงแรงดันไฟฟ้า แม้แต่แรงดันไฟฟ้ากระแสตรงขาออกของแบตเตอรี่ก็สามารถควบคุมให้อยู่ในระดับต่างๆได้โดยใช้ตัวแปลงไฟฟ้ากำลังเช่น สับ วงจร
โครงสร้างของเซลล์
โครงสร้างของเซลล์แห้งสังกะสี - คาร์บอนแสดงไว้ในรูป ประกอบด้วยขั้วแอโนดเป็นสังกะสีหรือแท่งกราไฟต์ทั่วไป คาร์บอนสร้างขั้วแคโทด อาจสังเกตได้ว่าในเซลล์แห้งรุ่นเก่าจะใช้สังกะสีเป็นแคโทดและใช้กราไฟต์เป็นขั้วแอโนด การเลือกองค์ประกอบนั้นขึ้นอยู่กับโครงสร้างทางเคมีของวงโคจรนอกสุดขององค์ประกอบ

โครงสร้างเซลล์แห้ง
หากมีจำนวนอิเล็กตรอนมากกว่าในวงโคจรนอกสุดก็สามารถทำหน้าที่เป็นผู้บริจาคได้และด้วยเหตุนี้จึงสร้างแคโทด ในทำนองเดียวกันถ้าวงโคจรนอกสุดมีอิเล็กตรอนน้อยกว่าก็สามารถรับได้ง่ายและด้วยเหตุนี้จึงสร้างขั้วบวก อิเล็กโทรไลต์ที่วางอยู่ระหว่างทำหน้าที่เป็นตัวเร่งปฏิกิริยาสำหรับปฏิกิริยาเคมี โดยทั่วไปเราใช้แอมโมเนียมคลอไรด์เยลลี่เป็นอิเล็กโทรไลต์ ในรูปที่แสดงอิเล็กโทรไลต์ที่ใช้เป็นส่วนผสมของสังกะสีและคลอไรด์ นอกจากนี้โซเดียมคลอไรด์ยังใช้เป็นอิเล็กโทรไลต์ ส่วนผสมของแมงกานีสไดออกไซด์และคาร์บอนล้อมรอบแท่งขั้วบวก
โครงร่างทั้งหมดวางอยู่ในท่อโลหะ วุ้นถูกป้องกันไม่ให้แห้งโดยใช้ระยะห่างที่ด้านบนของเซลล์ เครื่องซักผ้าคาร์บอนวางอยู่ที่ด้านล่าง จุดประสงค์ของเครื่องซักผ้านี้คือเพื่อป้องกันไม่ให้แท่งขั้วบวกสังกะสีสัมผัสกับภาชนะ
เรียกอีกอย่างว่าตัวเว้นวรรคตามที่แสดงในแผนภาพ นอกจากนี้สังกะสียังล้อมรอบด้วยฉนวนกระดาษเพื่อเป็นฉนวนกันความร้อน สำหรับแบตเตอรี่ขนาดใหญ่จะใช้วัสดุฉนวนอื่น ๆ เช่นไมกาเป็นต้น ขั้วบวกของวงรีเกิดขึ้นที่ด้านบน ขั้วลบของเซลล์เกิดขึ้นที่ฐาน
การทำงานของเซลล์แห้ง
เซลล์แห้งทำงานโดยพื้นฐานเกี่ยวกับปฏิกิริยาทางเคมี เนื่องจากปฏิกิริยาที่เกิดขึ้นระหว่างอิเล็กโทรไลต์และอิเล็กโทรดอิเล็กตรอนจึงไหลจากอิเล็กโทรดหนึ่งไปยังอีกขั้วหนึ่ง สารเช่นกรดละลายในน้ำเพื่อสร้างอนุภาคที่แตกตัวเป็นไอออน อนุภาคที่แตกตัวเป็นไอออนมีสองประเภท ไอออนบวกเรียกว่าไอออนบวกและไอออนลบเรียกว่าแอนไอออน กรดที่ละลายในน้ำเรียกว่าอิเล็กโทรไลต์
ในแผนภาพดังกล่าวข้างต้นสังกะสีคลอไรด์ก่อตัวเป็นอิเล็กโทรไลต์ แอมโมเนียมคลอไรด์เยลลี่ในทำนองเดียวกันก็เป็นอิเล็กโทรไลต์เช่นกัน แท่งโลหะที่แช่อยู่ในอิเล็กโทรไลต์จะสร้างอิเล็กโทรด จากลักษณะทางเคมีของแท่งโลหะเรามีขั้วบวกเป็นขั้วบวกและขั้วลบเป็นแคโทด
อิเล็กโทรดจะดึงดูดไอออนที่มีประจุตรงข้ามกันไปทางด้านข้าง ตัวอย่างเช่นแคโทดดึงดูดแอนไอออนและแอโนดจะดึงดูดไอออนบวก ในกระบวนการนี้อิเล็กตรอนจะไหลจากทิศทางหนึ่งไปยังอีกทิศทางหนึ่งดังนั้นเราจึงได้รับการไหลของประจุ นี้เรียกว่า ปัจจุบัน .
ปฏิกริยาเคมี
ปฏิกิริยาที่เกิดขึ้นในเซลล์ดังแสดงด้านล่าง ประการแรกคือปฏิกิริยาออกซิเดชั่น

ด้วยเหตุนี้แคโทดของสังกะสีจะถูกออกซิไดซ์เป็นไอออนของสังกะสีที่มีประจุบวกซึ่งปล่อยไอออนสองตัว อิเล็กตรอนเหล่านี้ถูกรวบรวมโดยขั้วบวก จากนั้นเกิดปฏิกิริยารีดักชัน

ปฏิกิริยารีดักชันที่ขั้วบวกแสดงไว้ด้านบน ปฏิกิริยานี้ก่อให้เกิดกระแสไฟฟ้า มันจะปล่อยไอออนออกไซด์ออกมาพร้อมกับแมกนีเซียมออกไซด์ ปฏิกิริยานี้จะเกิดขึ้นเมื่อแมกนีเซียมรวมกับอิเล็กโทรไลต์


อีกสองปฏิกิริยาแสดงถึงปฏิกิริยากรดเบสและปฏิกิริยาการตกตะกอนที่เกิดขึ้นในเซลล์แห้ง ในปฏิกิริยากรดเบส NH จะรวมกับ OH เพื่อผลิต NH3 พร้อมกับน้ำ ผลลัพธ์คือ NH3 และฐานน้ำ
ความแตกต่างระหว่างเซลล์แห้งและเซลล์เปียก
ความแตกต่างหลักระหว่างเซลล์แห้งและเซลล์เปียกคือรูปแบบของอิเล็กโทรไลต์ ตามที่กล่าวไว้ก่อนหน้านี้ในเซลล์แห้งอิเล็กโทรไลต์เช่นแอมโมเนียมคลอไรด์จะแห้งในธรรมชาติ เซลล์แห้งดังกล่าวพบได้บ่อยและใช้ในของเล่นวิทยุ ฯลฯ แต่ในเซลล์เปียกอิเล็กโทรไลต์จะอยู่ในสถานะของเหลว
ใช้อิเล็กโทรไลต์เหลวเช่นกรดซัลฟิวริกซึ่งเป็นของเหลวที่มีฤทธิ์กัดกร่อนที่เป็นอันตราย เนื่องจากลักษณะของของเหลวดังกล่าวเซลล์เปียกจึงระเบิดได้มากกว่าในธรรมชาติและจำเป็นต้องจัดการด้วยความระมัดระวัง ข้อได้เปรียบที่ดีที่สุดของเซลล์เปียกดังกล่าวคือสามารถชาร์จใหม่ได้ง่ายและใช้สำหรับการใช้งานจำนวนมาก แบตเตอรี่ดังกล่าวพบการใช้งานทั่วไปในการบินสาธารณูปโภคที่เก็บพลังงานและเสาสัญญาณโทรศัพท์มือถือ
หน้าที่ของเซลล์แห้ง
การทำงานของเซลล์แห้งขึ้นอยู่กับปฏิกิริยาทางเคมีระหว่างอิเล็กโทรดและอิเล็กโทรไลต์ เมื่ออิเล็กโทรดถูกวางไว้ในอิเล็กโทรไลต์จะดึงดูดไอออนที่มีประจุตรงข้ามเข้าหาตัวเอง สิ่งนี้ทำให้เกิดการไหลของประจุและด้วยเหตุนี้จึงเกิดกระแส
ข้อดี
ข้อดีของเซลล์แห้ง รวมสิ่งต่อไปนี้
- เซลล์แห้งมีข้อดีหลายประการเช่น
- มีขนาดเล็ก
- แรงดันไฟฟ้าสามารถมีได้หลายระดับ
- สะดวกและมีแอพพลิเคชั่นมากมาย
- เป็นแหล่งเดียวของแรงดันไฟฟ้ากระแสตรง
- สามารถใช้ร่วมกับวงจรอิเล็กทรอนิกส์กำลังเพื่อควบคุมแรงดันไฟฟ้าขาออก
- เป็นแบบชาร์จไฟได้
ข้อเสีย
ข้อเสียของเซลล์แห้ง รวมสิ่งต่อไปนี้
- จะต้องได้รับการจัดการด้วยความระมัดระวัง
- มันเป็นวัตถุระเบิด
- แบตเตอรี่ขนาดใหญ่มีน้ำหนักมาก
การใช้งาน
การใช้งานเซลล์แห้ง รวมสิ่งต่อไปนี้
- ของเล่น
- การบิน
- โทรศัพท์มือถือ
- วิทยุ
- เครื่องคิดเลข
- นาฬิกา
- เครื่องช่วยฟัง
ดังนั้นเราจึงได้เห็นการดำเนินการการจำแนกประเภทและการใช้งาน เซลล์แห้ง . ประเด็นที่น่าสนใจอย่างหนึ่งคือแบตเตอรี่จะทำงานได้ก็ต่อเมื่อขั้วไฟฟ้าสัมผัสกันเท่านั้น ต้องมีสื่อนำไฟฟ้าระหว่างขั้วไฟฟ้าทั้งสอง คำถามคือน้ำสามารถใช้เป็นสื่อนำไฟฟ้าระหว่างอิเล็กโทรดของเซลล์แห้งได้หรือไม่? ในกรณีนี้จะเกิดอะไรขึ้นถ้าเซลล์นี้จุ่มลงในน้ำ?